Dalam dunia kimia, asam dan basa adalah dua jenis senyawa yang memiliki peranan penting. Mereka membentuk dasar reaksi kimia dan berperan dalam banyak proses alami maupun industri.
Dalam artikel ini, kita akan membahas tentang klasifikasi asam dan basa, serta langkah-langkah cara membuat larutan asam dan basa.
Sifat Asam dan Basa
Asam dan basa memiliki sifat-sifat khas yang membedakan keduanya. Asam cenderung memiliki rasa masam, dapat menghasilkan ion H+ (hidrogen), dan memiliki pH kurang dari 7. Sebaliknya, basa cenderung memiliki rasa pahit, dapat menghasilkan ion OH- (hidroksida), dan memiliki pH lebih dari 7.
Contoh umum asam adalah asam klorida (HCl), sedangkan contoh basa adalah natrium hidroksida (NaOH).
Klasifikasi Asam dan Basa
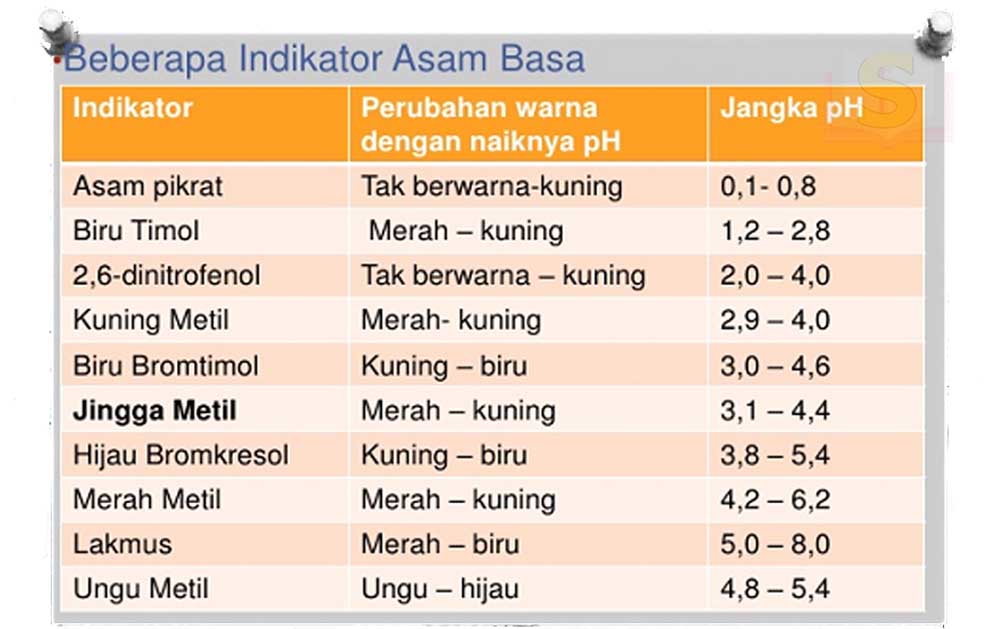
Asam Kuat
Asam kuat adalah asam yang sepenuhnya terionisasi dalam larutan air, menghasilkan ion H+ secara sempurna. Contohnya adalah asam sulfat (H2SO4) yang terdisosiasi sepenuhnya menjadi ion hidrogen dan ion sulfat dalam larutan.
Berikut beberapa contoh asam kuat :
- Asam nitrat (HNO3)
- Asam hidrogen iodida (HI)
- Asam klorida (HCl)
- Asam perklorat (HClO4)
- Asam bromida (HBr)
- Asam sulfat (H2SO4)
- Asam klorat (HClO3)
Basa Kuat
Basa kuat juga memiliki sifat serupa, di mana basa ini juga sepenuhnya terionisasi dalam larutan air dan menghasilkan ion OH- secara penuh.
Contoh basa kuat adalah kalium hidroksida (KOH), yang terdisosiasi sepenuhnya menjadi ion kalium dan ion hidroksida dalam larutan.
Beberapa contoh basa kuat diantaranya :
- Barium hidroksida (Ba(OH2)
- Stronsium hidroksida (CsOH)
- Kalsium hidroksida (Ca(OH2)
- Litium hidroksida (LiOH)
- Natrium hidroksida (NaOH)
- Rubidium hidroksida (RbOH)
- Sesium hidroksida (CsOH)
- Kalium hidroksida (KOH)
Asam Lemah
Asam lemah hanya sebagian terionisasi dalam larutan air, menghasilkan ion H+ secara parsial. Contohnya adalah asam asetat (CH3COOH), yang hanya sebagian ionisasi menjadi ion hidrogen dan ion asetat dalam larutan.
Berikut beberapa contoh asam lemah :
- Asam karbonat (H2CO3)
- Asam sulfat (H2SO4)
- Asam sianida (HCN)
- Asam hipoklorit (HClO)
- Asam askorbat (H2C6H6O6)
- Asam benzoat (C6H5COOH)
- Asam fosfat (H3PO4)
- Asam fluoride (HF)
- Asam asetat (CH3COOH)
- Hidrogen peroksida (H2O2)
- Asam borat (H3BO3)
- Asam metanoat (HCO2H)
- Asam format (HCOOH)
- Asam oksalat (HO2C2O2H)
Basa Lemah
Basa lemah juga memiliki sifat yang serupa, dengan hanya sebagian dari basa ini terionisasi dalam larutan air. Contoh basa lemah adalah amonia (NH3), yang hanya sebagian menghasilkan ion hidroksida dan ion amonium dalam larutan.
Beberapa contoh basa lemat diantaranya :
- Seng hidroksida (Zn(OH)2)
- Besi (II) hidroksida (Fe(OH)2)
- Metilamin hidroksida (CH3NH3OH)
- Natrium bikarbonat (NaHCO3)
- Amonium hidroksida (NH4OH)
- Timbal (II) hidroksida (Pb(OH)2)
- Etilamin hidroksida (C2H5NH3OH)
- Tembaga (II) hidroksida (Cu(OH)2)
- Amonia (NH3)
Cara Membuat Larutan Asam dan Basa
Larutan Asam: Reaksi dengan Oksida Asam
Larutan asam bisa dihasilkan melalui reaksi air dengan oksida asam. Oksida adalah senyawa yang terbentuk dari oksigen dan unsur tertentu. Jenis oksida yang terlibat dalam pembentukan larutan asam adalah oksida asam, yang terdiri dari oksigen dan unsur nonlogam seperti P2O5, CI2O7, SO2, atau CO2.
Beberapa reaksi yang menghasilkan larutan asam antara lain:
- CI2O7(g) + H2O(I) -> P2O5(s) + H2O(I)
- CO2(g) + H2O(I) -> H2CO3(aq)
- SO3(g) + H2O(I) -> SO3(g) + H2O(I)
- P2O5(s) + H2O(I) -> H2SO4(aq)
Larutan Basa: Reaksi dengan Oksida Basa
Sementara itu, larutan basa terbentuk melalui reaksi antara air dan oksida basa. Oksida basa adalah senyawa yang terbentuk dari oksigen dan unsur logam seperti Fe2O3, Na2O, atau CaO.
Contoh reaksi yang menghasilkan larutan basa meliputi:
- Fe2O2(s) + 3H2O(I) -> 2Fe(OH)2(aq)
- Na2O(s) + H2O(I) -> 2NaOH(aq)
- CaO(s) + H2O(I) -> Ca(OH)2(aq)
Jenis Oksida Lainnya
Terdapat beberapa jenis oksida dengan sifat yang berbeda-beda. Oksida indiferen adalah jenis oksida yang tidak dapat menghasilkan larutan asam atau basa. Contohnya termasuk senyawa NO dan CO. Di sisi lain, oksida amfoter memiliki kemampuan untuk bereaksi dengan ion asam (H+) dan ion basa (OH-). Contoh oksida amfoter adalah ZnO dan AI2O3.
Penting untuk memahami bahwa pembuatan larutan asam dan basa melibatkan reaksi kimia yang kompleks. Ketelitian dan pemahaman tentang jenis oksida serta reaksi yang terlibat sangatlah penting. Sebelum melakukan percobaan, pastikan untuk mengenakan perlindungan seperti sarung tangan dan kacamata pelindung guna menjaga keselamatan.
Penutup
Dalam artikel ini, kita telah membahas klasifikasi asam dan basa, serta memberikan panduan langkah demi langkah tentang cara membuat larutan asam dan basa. Mengetahui perbedaan antara asam kuat, asam lemah, basa kuat, dan basa lemah adalah kunci untuk memahami bagaimana zat-zat ini bereaksi dalam berbagai situasi.
Dengan mengikuti langkah-langkah yang tepat, Anda dapat membuat larutan asam dan basa yang sesuai dengan kebutuhan Anda. Jadi, mulailah eksplorasi Anda dalam dunia yang menarik ini dan buatlah kontribusi yang berarti dalam bidang kimia!

